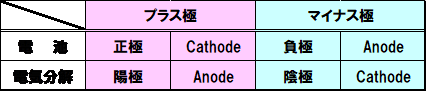
電池も電気分解も電気と化学反応が関与する一見同じ様なシステムですが、電極の呼び方が異なります。電池の場合はプラス極を正極、マイナス極を負極と呼びますが、電解の場合はそれぞれ陽極、陰極と呼ぶようになっています。英語ではCathode(カソード)とAnode(アノード)で表現され、以下の様な関係になりますが、これが少々ややこしいことになります。電解は電気・電子分野と同じですが、電池を扱う際に勘違いされることも少ないので注意が必要です。
今はほとんど目にすることがなくなったブラウン管はCRT(Cathode-Ray Tube:陰極線管)という電子部材で、ここでもカソードが使われています。コンピュータ等に採用されているLCDのモニターのことをTVとかCRTとか呼ぶ方も少なくありませんが、本来の意味からすると全く違います。会話では通じますが、できるだけ正しく理解して正しく使いましょう。
CathodeとAnodeは酸化還元反応と関与しており、酸化反応が起こる側をAnodeで還元反応側がCathodeとなっています。平井先生の講義で学んだことです。酸化還元反応は単に酸素との関係だけでなく、電子の授受で定義(このことは自体は高校の化学で登場)されています。

厳密に言うと二次電池の場合は、放電時と充電時では酸化還元反応が逆転するのですが、放電側に主眼を置いた形になっています。充電時の電池内部では電解と同じ様な状態となっています。
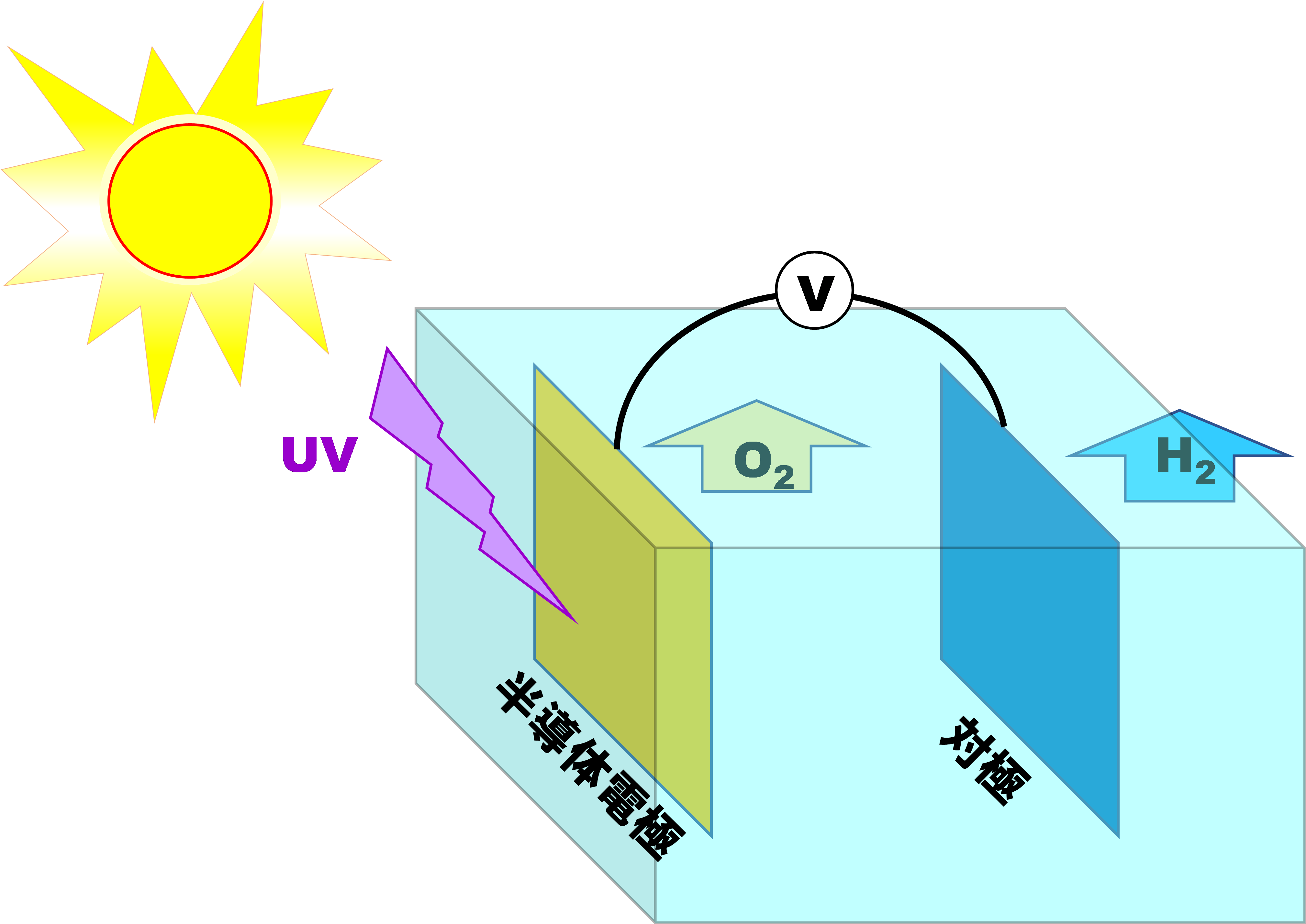
電解というと最近注目されているのが水の電気分解が有名ですが、産業界の色々な分野で活用されています。鉄(スチール)の防食や装飾のために使われるメッキも電解ですし、金属を精製するために使用されることも少なくありません。
正極材として使用されている二酸化マンガンも電解によって製造されるものもあり、リチウムイオン電池の負極の芯体に使われている銅箔も現在ではほとんどが電解で製造された電解銅箔と呼ばれるものが採用されています。
金属の腐食も単に酸化反応だけでなく、近くで還元反応も起こっています。局部的に電池が出来ながら進行することになります。乾燥したところでは錆が発生し難いのは電解液の確保ができないからであると考えられます。水蒸気が結露した水分には電解質となるものがありませんが、汚れ等が水分に溶解して、電気を流す水溶液へと変化していることになります。
逆にこの様な特徴を利用してメッキの様に直接的な保護だけでなく、電位を利用した防食技術も活用されています。
この様に身の回りには電池に繋がる様な反応が多く点在しています。